發(fā)布時(shí)間:2023-10-25
在 10 月 20-24 日于西班牙馬德里舉行的 2023 年歐洲腫瘤內(nèi)科學(xué)會(huì) (ESMO) 大會(huì)上,邁威生物 9MW2821(靶向 Nectin-4 ADC)用于晚期實(shí)體瘤患者的 I/II 期研究的初步結(jié)果由復(fù)旦大學(xué)附屬腫瘤醫(yī)院張劍教授代表研究團(tuán)隊(duì)進(jìn)行了報(bào)告。此外,8MW0511 的 III 期研究結(jié)果也在會(huì)上以壁報(bào)形式展示。

2023 ESMO:張劍教授進(jìn)行現(xiàn)場報(bào)告
9MW2821 口頭報(bào)告
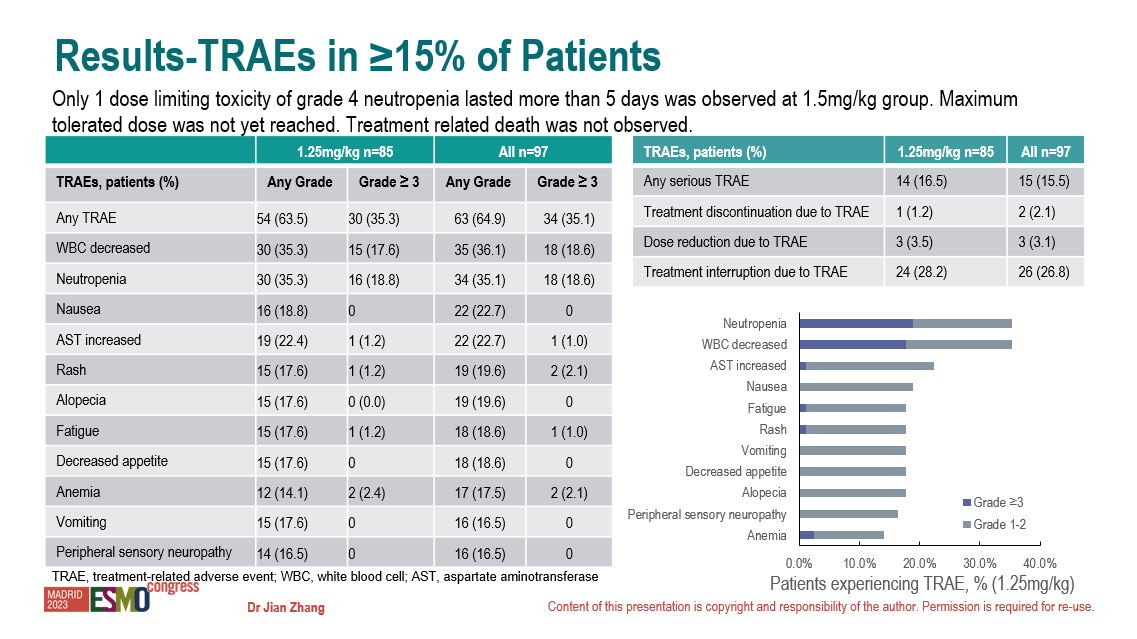
研究背景: Nectin-4 是一種在包括尿路上皮癌在內(nèi)多種實(shí)體瘤中高度表達(dá)的粘附分子,可作為有效治療靶點(diǎn)。9MW2821 是一種單克隆抗體-藥物偶聯(lián)物 (ADC),能將 MMAE 釋放到表達(dá) Nectin-4 的細(xì)胞中。本研究評(píng)估了該藥物在實(shí)體瘤患者中的安全性、耐受性和初步療效。 研究方法: 9MW2821 在每 28 天為 1 個(gè)周期的第 1 天、第 8 天和第 15 天通過靜脈輸注給藥。研究包括劑量遞增、劑量擴(kuò)展和隊(duì)列擴(kuò)展期。隊(duì)列中包括尿路上皮癌和其他 Nectin-4 陽性實(shí)體瘤受試者。主要目標(biāo)為評(píng)估該藥物的安全性和初步療效。 研究結(jié)果: 截至 2023 年 4 月 27 日,該研究共入組 97 名患者,其中包括尿路上皮癌患者 39 例,宮頸癌患者 29 例。患者的年齡范圍為 32-78 歲(年齡中位數(shù)為 57 歲),劑量范圍為 0.33 至 1.5mg/kg。這些受試者既往接受過鉑類化療和免疫檢查點(diǎn)抑制劑治療。 研究中未發(fā)生與治療相關(guān)的死亡事件。在 1.5mg/kg 組僅觀察到 1 例劑量限制性毒性,為 4 級(jí)中性粒細(xì)胞減少持續(xù)大于 5 天。最大耐受劑量尚未達(dá)到。 研究中,任何級(jí)別的治療相關(guān)不良事件的發(fā)生率為 64.9%。最常見的治療相關(guān)不良事件是白細(xì)胞計(jì)數(shù)降低 (36.1%),中性粒細(xì)胞減少 (35.1%),惡心 (22.7%),天冬氨酸氨基轉(zhuǎn)移酶升高 (22.7%),皮疹 (19.6%),脫發(fā) (19.6%),疲勞 (18.6%),食欲減退 (18.6%),貧血 (17.5%),嘔吐 (16.5%),外周感覺神經(jīng)病 (16.5%)。3/4 級(jí)治療相關(guān)不良事件的發(fā)生率為 35.1%,最常見的是白細(xì)胞計(jì)數(shù)降低 (18.6%) 和中性粒細(xì)胞減少 (18.6%)。
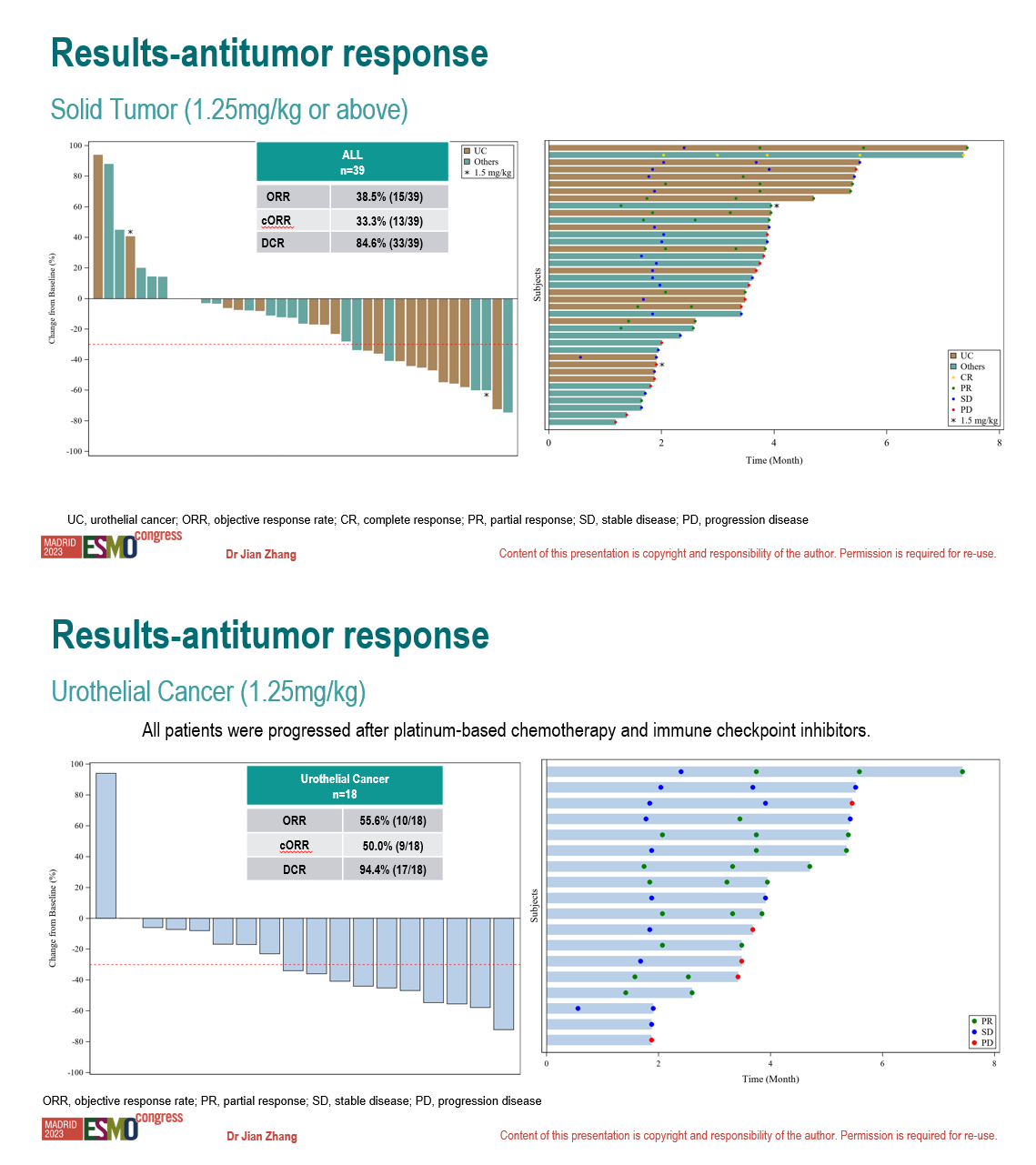
在接受 1.25mg/kg 或以上劑量 9MW2821 治療的 39 例實(shí)體瘤可腫評(píng)受試者中,客觀緩解率 (ORR) 和 疾病控制率 (DCR) 分別為38.5% 和 84.6%。在 1.25mg/kg 劑量組的 18 例尿路上皮癌可腫評(píng)受試者中,ORR 和 DCR 分別為 55.6% 和 94.4%。此外,9MW2821 在乳腺癌和宮頸癌患者中也觀察到了客觀緩解。
結(jié)論:
? 9MW2821 擁有良好可控的安全性。血液學(xué)毒性作為最常見的不良反應(yīng),被認(rèn)為可控、可耐受且可逆轉(zhuǎn)。
? 除尿路上皮癌外,9MW2821 在其他癌種中也觀察到具有前景的抗腫瘤活性。
? 多適應(yīng)癥拓展研究還在繼續(xù)開展以確定其療效。
8MW0511 壁報(bào)展示
注射用重組(酵母分泌型)人血清白蛋白-人粒細(xì)胞集落刺激因子融合蛋白 8MW0511 在 ESMO 大會(huì)上以壁報(bào)形式發(fā)布 III 期研究結(jié)果。研究顯示8MW0511 有確切的臨床療效,非劣于陽性對(duì)照藥物,能夠改善 4 級(jí)中性粒細(xì)胞降低的發(fā)生率和持續(xù)時(shí)間,其中第 2-3 周期 4 級(jí)中性粒細(xì)胞降低發(fā)生率明顯低于陽性對(duì)照組。總體安全性與陽性對(duì)照組相似,人體用藥安全可控,耐受性較好。